Нарушение метилирования гена RELN при галлюцинаторно-параноидном синдромех
Нарушения функций гена RELN, как полагают, могут играть важную роль в этиологии галлюцинаторно-параноидного синдрома при шизофрении. С эпигенетическими функциями гена RELN связано развитие нейромедиаторных систем, в частности, дофаминергической, глутаматергической и ГАМК-ергической.
Доказательства связи метилирования RELN с развитием параноидной шизофрении недостаточно убедительны, поскольку исследования возможно проводить лишь на немногочисленных посмертных образцах тканей головного мозга.
Метилирование ДНК в периферической крови может служить важным объективным фактором (reliable) и отражать изменения, происходящие в головном мозге.
Установлено, что дифференциальное метилирование регуляторных участков генов играет важную функционально значимую роль в развитии шизофрении в качестве «зеркального» функционального участка (mirror functional site).
Цель нашего исследования – изучение особенностей метилирования промоторов RELN и его роли в патогенезе галлюцинаторно-параноидного синдрома c использованием геномной ДНК, полученной из периферической крови больных параноидной шизофренией в состоянии психоза. В исследовании приняли участие 53 больных параноидной шизофренией и 57 испытуемых без психической и неврологической патологии.
После трансформации бисульфитом на основе различий количественного анализа Сq были рассчитаны уровни метилирования образцов ДНК, которые анализировались с использованием высокочувствительной «MethyLight»TaqMan ПЦР в реальном времени.
У больных с галлюцинаторно-параноидным синдромом, в отличие от нормы, было обнаружено деметилирование в области промотора -415 до -530. Данные о реципрокных изменениях метилирования в головном мозге и периферической крови на основе демитилирования в периферической крови позволяют считать, что в головном мозге происходит гиперметилированиегена RELN, которое может играть определённую роль в развитии галлюцинаторно-параноидного синдрома при шизофрении.
Исследования, проведенные методом фМРТ и Диффузионно-Тензорной Трактографии (Diffusion Tensory Tractography, DTI) на тех же больных шизофренией, что и метилирование, выявили у них нарушение нейронных сетей и связей между мозговыми структурами. В вызванных потенциалах (ВП) у этих больных обнаружены изменения параметров компонентов, свидетельствующие о нарушении процессов активации корковых зон в реакции на значимые стимулы.
Отклонения показателей различных уровней деятельности мозга могут быть связаны с патологией микроструктур головного мозга, развивающейся в онтогенезе и связанной с нарушениями гена RELN, а также с функциональной дисфункцией белка рилин.
Несмотря на многочисленные генетические нарушения, наблюдающиеся при шизофрении, такие как генные мутации, транслокация, полиморфизмы и дупликации [1], патогенез и этиология этого заболевания остаются не известными [2], [3].
Клиническая практика [4] и близнецовые исследования [5] не дают однозначных свидетельств наследования шизофрении. Отсутствие 100% конкордантности у монозиготных близнецов больных шизофренией подтверждают наличие дополнительных негенетических факторов в развитии патологии.
Существуют противоречивые данные в отношении наследования картины метилирования промоторных участков генов в геноме человека. Некоторые авторы предполагают наличие основополагающих генетических механизмов в развитии шизофрении. Однако, в последнее время становится все более актуальным взгляд дополняющий генетическую концепцию, а именно принимающий во внимание факторы окружающей среды [6].
В частности, практически уже доказанной является концепция (мнение), что в патогенезе шизофрении важная роль принадлежит эпигенетическим механизмам, среди которых ключевую роль играет метилирование ДНК как базовый механизм регуляторного воздействия окружающей среды, реализующий адаптивный ответ организма, особенно в периоды раннего развития (пренатальные и постнатальные) организма.
Метилирование ДНК, относящееся к эпигенетическим механизмам, может явиться либо этиологическим фактором, либо результатом фармакотерапии шизофрении [7], [8], что показано в исследованиях, проводимых с помощью выявления (выделения) генов-кандидатов и полногеномных исследований (полного генома) [9], [10], [11].
Хотя генетические факторы заболевания исследованы достаточно широко, анализ сцепленного наследования и полногеномный поиск ассоциаций (GWAS ассоциаций генов целого генома) позволяют лишь частично предположить, какие этиологические факторы могут лежать в основе шизофрении, и, в частности галлюцинаторно-параноидного синдрома [12].
Наряду с другими факторами, препятствием для генетических исследований стали неменделевский характер наследования шизофрении, гетерогенность фенотипов и отсутствие специфических биомаркеров.
Анализ базы данных SchizophreniaGene
сайта Schizophrenia Research Forumпо состоянию на январь 2017, показал, что в ходе проведенных 1300 генетических исследований значительные суммарные показатели нарушений генетических механизмов получены для нескольких локусов, включая гены метил-тетра-гидро-фолатредуктазы (MTHFR), дофаминового рецептора D2, дофаминового рецептора D4, различных субъединиц рецептора NMDA (NR2A, GRIN2A) и серотонинового транспортера A4 (SLC6A4).
В некоторых работах также продемонстрировано наличие нарушений пептидов дисбиндина и нейрегулина при шизофрении[13]. Однако, несмотря на информативность анализа сцепленного наследования и генов, ассоциированных с шизофренией, интерпретацию данных усложняет комплексный характер генетики при этом заболевании.
Согласно существующим гипотезам значительную роль в нарушениях, обнаруженных при шизофрении, играет гипофункция NMDA рецепторов, которая сопряжена с гиперактивностью дофаминовой системы. Глутаматные нейроны регулируют функции других нейронов, играющих большую роль в патофизиологии шизофрении.
Большое значение в механизмах имеет изменение при шизофрении морфологии ГАМК-ергических интернейронов [14], а также тот факт, что дофаминовые нейроны являются мишенью антипсихотических лекарственных средств. Например, залпы дофаминовых нейронов, считающиеся компонентом их нормальной реакции на стимулы внешней среды, зависят от активации NMDA-рецепторов [15].
Результаты исследований показывают, что гипофункция NMDA-рецепторов может приводить к изменениям дофаминовой системы, подобных тем, что наблюдаются при шизофрении - субкортикальному избытку DA и повышению количества кортикальных D1-рецепторов [16].
Более новые исследования показывают, что NMDA-антагонисты вызывают в ГАМК-нейронах некоторые из изменений, описанных при шизофрении [17]. Глутаматергические и ГАМКергические отклонения при шизофрении могут быть взаимосвязаны и вызывать или ассоциироваться как с неэффективным контролем входящих сигналов в субкортикальную стриарную дофаминовую систему, так и с неэффективной кортико-кортикальной связностью и функционированием этих связей.
Существующая эпигенетическая гипотезап редполагает, что при шизофрении имеет место аберрантная экспрессия генов, например, глутаматдекарбоксилазы-1 – GAD-1 или GAD-67 везикулярного ГАМК-транспортера-(VGAT), ГАМК транспортера - GAT-1, субъединица NR2, которая кодирует NMDA-рецептор [15], [16], и влияет на ГАМК-ергические нейроны.
Эти процессы, как предполагается, обусловлены, гиперметилированием промоторов, опосредованного чрезмерной экспрессией ДНК-метилтрансферазы-I (и, возможно, других ДНК-метилтрансфераз) [17].
Имеются также дополнительные механизмы эпигенетической регуляции ключевых промоторов, экспрессированных в ГАМК-ергических и глутаматергических нейронах. Каждый из механизмов может снижать экспрессию соответствующих мРНК, подавляя промоторы [18].
Нарушение экспрессии мРНК рилина (ген RELN), приводит к дисбалансу взаимодействия ГАМК-ергическихи глутаматергических нейронов, и этот процесс может влиять на нарушение торможения нейронных сетей коры головного мозга [19],[20].
Гликопротеин reelin (RELN) принимает участие в миграции и позиционировании различных нейронных путей, нервных стволовых клеток в ранние периоды развития, играет значительную роль в процессах элиминации и прунинга в нейроонтогенезе, модулирует синаптическую пластичность, усиливает и поддерживает долговременную потенциацию, стимулирует развитие дендритов и дендритных шипиков [21].
В развитом мозге рилин секретируется ГАМК-ергическими вставочными нейронами структур темпоролимбической системы и неокортекса.
На сегодняшний день результаты исследования связи между метилированием гена RELN и шизофренией дают достаточно противоречивые результаты. Одно из ранних исследований, проведенное на посмертных образцах головного мозга как здоровых, так и больных, выявило, что гиперметилирование гена RELN часто имеет место при шизофрении [22].
Эти результаты, однако, не были подтверждены исследованием, проведенным с использованием метода пиросеквенирования [23] и другим недавним исследованием, в котором использовалось MSP метод и бисульфитное секвенирование (MSP и бисульфита) с участием 9 больных и 4 здоровых посмертных образцов тканей головного мозга [24].
Во всех перечисленных исследованиях результаты статистически не значимы, поскольку анализировалось небольшое количество посмертных образцов тканей головного мозга.
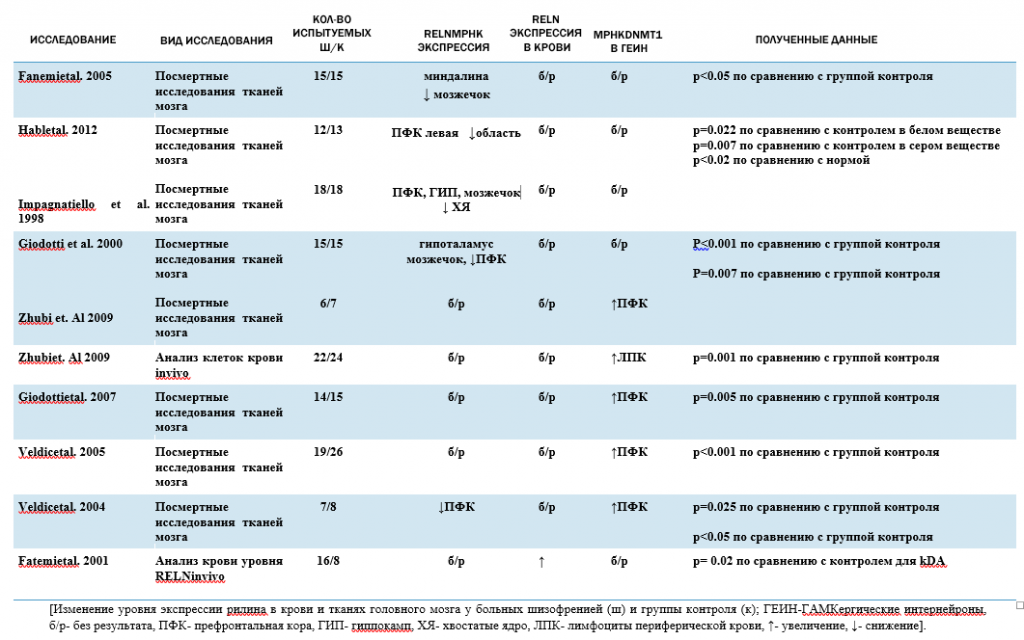
Табл.1. В таблице приведены данные различных авторов об исследованиях метилирования гена RELN при шизофрении.
Таблица 1. Краткое описание сводных данных исследований гена RELN при шизофрении.
Имеются исследования, которые указывают на обратное соотношение экспрессии RELN в крови и мозге при шизофрении [Табл. 1].Существующие данные о том, что уровень экспрессии RELN в крови у больных шизофренией повышен по сравнению с нормой подтверждаются посмертными исследованиями, которые указывают на уменьшение мРНКRELN в головном мозге у этих больных [25], [26].
Снижение мРНКRELN может способствовать уменьшению длины дендритов и понижению плотности дендритных шипиков в префронтальной и других областях коры, гиппокампе, гипоталамусе, миндалине, продолговатом мозге, а также в среднем мозге [27], [28]. Однако в исследовании экспрессии рилина в периферической крови были больные с преобладанием негативной симптоматики, а также получавшие нейролептическую терапию [29].
Таким образом, хотя эти исследования не дают уверенности в наличии реципрокных отношений между центральным и периферическим метилированием гена RELN,на сегодняшний день считается что у больных шизофренией имеет место гиперметилирование гена RELN в мозге [30], [31].
Целью нашего исследования было выявить различия метилирования у больных шизофренией с галлюцинаторно-параноидным синдромом в состоянии психоза без приема нейролептической терапии и здоровых испытуемых путем анализа ДНК, полученной из периферической крови.
Эти отличия могут во-первых послужить биологическими маркерами, а во вторых подойти к пониманию мозговой дисфункции биохимических и нейрофизиологических показателей.
Материалы и методы
Испытуемые. Исследование проводилось на базе психиатрической больницы РОСА (отделение острых психозов) совместно с Институтом Высшей Нервной Деятельности и Нейрофизиологии РАН, лаборатория психофизиологии.
В группу больных вошли 57 человек (29 мужчин и 28 женщин) страдающих шизофренией в острый психотический период с преобладанием галлюцинаторно-параноидного синдрома в возрасте от 19 до 33 лет.
Диагноз ставился врачами-психиатрами отделения острых психозов, по критериям Международной Классификации Болезней10-ого пересмотра (МКБ-10) категория F20.0.
Общая сумма баллов выраженности психопатологических симптомов определялась по шкале PANSS, у пациентов составляла 98.1±2.1. Все пациенты были с первым психотическим приступом и не получали нейролептического антипсихотического лечения, до и во время эксперимента.
В качестве контрольной группы было исследовано 53 здоровых испытуемых (28 мужчин, 25 женщин) в возрасте от 19 до 28 лет. В исследование отбирались, как в группу контроля, так и в группу больных шизофренией, испытуемые без соматической и неврологической патологии.
Статистически значимых различий по полу, возрасту и уровню образования между исследованными группами обнаружено не было (р>0.01).
Этическое соглашение. Разрешение этического комитета Института Высшей Нервной Деятельности и Нейрофизиологии РАН было получено до начала исследования.
Молекулярно-генетические методы
Был проведен скрининг панели ДНК, выделенной из лейкоцитов периферической крови на метилирование промоторной области гена RELN.
Образцы крови собирали в специализированные стеклянные пробирки с раствором К3EDTA (BD Vacutainer™ K3EDTA). ДНК выделяли с использованием методик гемолизиса и с использованием магнитных наночастиц в соответствии с протоколами фирм («БиРет», «Силекс», РФ).
В случае последнего метода удалось получить интактную РНК вместе с ДНК, пригодную как для анализа на метилирование, так и для анализа уровня экспрессии гена по кДНК после обратной транскрипции и TaqMan РТ ПЦР для гена RELN.
ПЦР-амплификацию конвертированной бисульфитом ДНК CpG–богатых участков (фрагментов) области промотора гена RELN (около 550 п.н.), (содержащих последовательность CpG динуклеотидов), осуществляли в две стадии: изначально использовали подобранные первые пары затравок, амплифицировали более крупный фрагмент (450 п.н.), затем внутри этой последовательности более короткий фрагмент (320 п.н.).
Условия ПЦР: 94°С /4 мин × 1 цикл; 94°С /1 мин, 61°С /2 мин, 72°С /2 мин × 5 циклов; 94°С /1 мин, 61°С/1,5 мин, 72°С/1,5-2 мин × 25 циклов; 72°С/5 мин × 1 цикл.
Метилирование изучали путем бисульфитной трансформации образцов ДНК.
Бисульфитная трансформация проводилась с 1-2 мкг ДНК, которую обрабатывали бисульфитом, с незначительными изменениями. ДНК денатурировали 0,3 N NaOH при 37°С в течение 15 мин. 15 мкл свежеприготовленного 10 мМ гидрохинона добавляли в пробирки с образцами ДНК, растворы тщательно перемешивали с помощью инверсии с минимальной аэрацией, 250 мкл свежеприготовленного бисульфита натрия 3.6 М, рН 5,0 добавляли в пробирки, инкубировали при 37°С и растворы вновь тщательно перемешивали с помощью инверсии с минимальной аэрацией.
Реакционные смеси покрывали минеральным маслом и инкубировали при 55°С 16 часов в темноте.
Водные фазы переносили в новые пробирки и обессоливали на колонках с ионообменной смолой. ДНК элюирировали 120 мкл дистиллированной воды, следы спирта удаляли при помощи центрифугирования. 10 микролитров 3N NaOH добавляли к 100 мкл обессоленной ДНК и инкубировали в течение 15 мин при 37°С.
ДНК осаждали 33 мкл10 М ацетата натрия рН 7,8 и 300 мкл охлажденного этанола с использованием гликогена в качестве соосадителя в ледяной бане в течение 10 мин, затем центрифугировали при 13000×g в течение 60 мин. Осадок ресуспендировали в 100 мкл ТЕ рН 8,0.
Полученные трансформированные бисульфитом препараты ДНК подвергали процедуре «гнездового» (nested) ПЦР, с использованием специфических затравок к указанным выше участкам области промотора гена содержащим GC пары.
Полученные амплификаты очищали от избытков затравок и неспецифических фрагментов электрофорезом в 2%-ной агарозе и затем вырезанные из геля полосы передавались на секвенирование соответствующих промоторных областей гена RELN («Синтол», РФ).
Физиологические исследования. Проведен анализ вызванных потенциалов (ВП) мозга на стимулы разной значимости по обычным протоколам. Анализировались латентность и амплитуда компонентов Р100, N170, P200, P300 иN400.На эти же стимулы изучались показатели фМРТ у тех же больных и анализировалась активация различных мозговых зон у здоровых и больных шизофренией.
Результаты
Анализ полученных результатов показал наличие у больных шизофренией деметилирования гена RELNв области промотора -415 до -530 сайт -442 у больных по сравнению с группой контроля, что может указывать на повышение экспрессии белка рилин.

Метилирование гена RELN, полученного из периферической крови (промоторная область от -415 до -530), сайт -44 у пациентов с шизофренией полностью отсутствует в 100% случаев, а при здоровом контроле 95% присутствует во всех пар CрG.
Обсуждение
Наши исследования выявили, что у больных шизофренией с галлюцинаторно-параноидным синдромом, не принимавших нейролептической терапии, в отличие от нормы, в периферической крови имеет место деметилирование гена RELN (промотор -415 до -530, сайт -442).
Литературные данные, указывающие на обратное соотношение экспрессии RELN в крови и мозге при шизофрении [32], свидетельствуют о гиперметилировании у больных гена RELN в мозге. (Табл. №3).
Такой подход может обеспечить ключевые данные, касающиеся статуса метилирования RELN в периферических тканях и его роли в развитии заболевания.
Неметилированные участки CpG вместе образуют кластеры, называемые CpG-островками, которые можно обнаружить в промоутерных зонах многих генов. Таким образом, то, что метилирование ДНК играет важную роль в регуляции экспрессии белка, является предсказуемым результатом [33].
Однако, не для всех ДНК характерна однонаправленность выраженности метилирования и экспрессии, в частности выраженность метилирования обратно коррелирует с экспрессией рилина [34].
Поскольку метилирование является фактором, определяющим экспрессию белка, можно предположить, что полученные нами данные о гиперметилировании гена RELN, указывают на снижение при шизофрении экспрессии белка рилин (reelin) в мозге.
В последние десятилетия была отмечена и получила экспериментальные подтверждения существенная роль вклада эпигенетики в этиологию шизофрении [35].
Эпигенетические исследования, то есть исследование изменений, не затрагивающих структуру гена, а именно метилирования, которое в свою очередь приводит к нарушению экспрессии белка рилин при шизофрении. Количество исследований метилирования ДНК на посмертных образцах мозговых тканей больных шизофренией ограничено, и большая их часть проводится на небольших выборках.
Волтон, используя височные доли мозга больных эпилепсией, а также их периферическую кровь, показал, что периферическая кровь может применяться в качестве суррогатного маркера мозговой ткани. Он предположил, что некоторые параметры, полученные на данных периферического метилирования, могут служить показателем статуса метилирования в мозге [36].
Волтон также отмечает, что нарушение метилирования ДНК при шизофрении влияет на нейронные связи, через предшественники метаболитов и сигнальные пептиды (рилин). Кроме посмертных образцов тканей мозга и периферической крови для анализа эпигенетических изменений можно использовать также мочу и слюну [37], [38].
Существующие данные о наличие широкого спектра воздействий материнского вскармливания на метилирование ДНК в мозге и Т-клетках макаки резус, поддерживает мнение о том, что влияние среды является системным и оказывает воздействие на геном в целом, сохраняя свое действие до взрослого возраста [39].
Подход Дэвиса, оценивающий целостный профиль метилирования, подтверждает результаты о том, что различные паттерны метилирования ДНК в мозге и крови в высокой степени коррелируют [40].
Кроме того, исследование Кленгеля, показывают, что деметилирование имеет глобальное воздействие на иммунные клетки и области, связанные с мозгом, на примере взаимосвязей между генетическими нарушениями и детской травмой[41].
Следует отметить, что периферическая кровь не может в полной степени заменить сложную структуру ткани мозга и ее составляющих. Степени корреляции метилирования ДНК между различными структурами мозговых тканей и периферической крови имеют различную вариабильность [42].
Согласно нейроинфламматороной [43] и нейроонтогенетической [44] гипотезам шизофрении, более тесную связь с кровью чем с мозгом выявляет микроглия, которая происходит от моноцитов крови, выявляющихся из гомопоэтических клеток-предшественников [45].
Таким образом, вне зависимости от сходства изменений в мозге и крови, разница в метилировании RELN у пациентов и группы контроля в нашем исследовании может отражать уникальную особенность шизофрении и являться периферическим маркером данного заболевания. Однако необходимо учитывать, что разница в метилировании может являться результатом конкретного вида терапии.
Работы Smalheiser выявили роль белка рилин в процессе развития; во взрослом периоде функции рилина обнаруживается в крови и других периферических органах [46].
Хотя повышенная не нейронная экспрессия RELN была обнаружена при патологиях печени [47] и глаз [48], причина, приводящая к экспрессии RELN в крови, не является до конца установленной.
Обнаруженное нами деметилирование ДНК в сайте CpG промоторной зоны гена RELN у больных с галлюцинаторно-параноидном синдромом при шизофрении свидетельствует о том, что нарушение метилирования ДНК гена RELN может играть важную роль в патогенезе шизофрении.
Важным предсталяется вопрос о взаимосвязи метилирования ДНК и приемом нейролептической терапии, поскольку Мелас (Melas) описал наличие такой взаимосвязи между метилированием ДНК в периферических лейкоцитах и антипсихотической терапией [49].
В связи с этим важно отметить, что в нашем исследовании больные не получали нейролептической терапии.
Заключение
В работе были выявлены различия в уровне метилирования промоторной зоны гена RELN в периферической крови у больных шизофренией с галлюцинаторно-параноидным синдромом.
Деметилирование гена RELN- потеря метильных групп затрагивает в основном район 5’ и промоторную зону гена, что приводит у этих больных к увеличению экспрессии белка рилин в периферической крови. Данные о наличии реципрокного соотношения между метилированием гена RELN в мозге и периферической крови, наблюдающегося только при шизофрении, подтверждает, что в мозге имеет место снижение экспрессии белка рилин.
Снижение экспрессии белка рилин в мозге в результате гиперметилирования гена RELN, может происходить как в онтогенезе, так и во взрослом состоянии, когда метилирование гена RELN «стирается» во время понижения уровня гидроксилирования метильных групп. Однако, точное воздействие метилирования на функцию RELN в онтогенезе и во взрослом состоянии будет требовать дальнейшего изучения (в том числе на материале тканей мозга), и должно проводиться с учетом предположения о реципрокных изменениях в тканях мозга и периферической крови.
В данной работе нами было получено деметилирование ДНК в сайте CpG промоторной зоны гена RELN у пациентов с галлюцинаторно-параноидном синдромом при шизофрении.
Так как рилин продуцируется нейронами и является сигнальной молекулой для формирования связей между ними, его концентрация критична для прорастания нейронных отростков. Таким образом, понижение экспрессии рилина искажает направление нейронных связей (axon/dendriteguidanceandtargetdirections) функция которых нарушается [50].
Снижение экспрессии белка рилин, секретируемого ГАМК-ергическими нейронами, приводит к нарушению соотношения нейромедиаторных систем: гипофункция глутамата и избыток дофамина, в результате чего развивается дисбаланс нейронных процессов возбуждения/торможения. На это указывает также выявленные нами однонаправленные изменения обоих параметров: и латентности, и амплитуды ВП, а также различие в активации мозговых зон на фМРТ у больных галлюцинаторно-параноидным синдромом.
Резюмируя, можно отметить, что в наших исследованиях, у больных с галлюцинаторно-параноидным синдромом на молекулярно-генетическом и физиологическом уровнях обнаруживаются парадоксальные соотношения экспрессии рилина кровь/мозг и сочетание увеличения и латентности, и амплитуды ВП, как одновременного проявления и возбуждения и торможения.
Список литературы
- Rees, E., O’Donovan, M.C., Owen, M.J., 2015. Genetics of schizophrenia. CurreOpinion in Behavioral Sciences 2, 8-14.
- Farrell, M.S., Werge, T., Sklar, P., Owen, M.J., Ophoff, R.A., O'Donovan, M.C., Corvin, A., Cichon, S., Sullivan, P.F., 2015. Evaluating historical candidate genes forschizophrenia. Mol Psychiatry 20 (5), 555-562.
- Maric, N.P., Svrakic, D.M., 2012. Why schizophrenia genetics needs epigenetics: a review.PsychiatrDanub 24 (1), 2-18.
- Kety, S.S., Wender, P.H., Jacobsen, B., Ingraham, L.J., Jansson, L., Faber, B., Kinney, D.K.,1994. Mental illness in the biological and adoptive relatives of schizophrenicadoptees. Replication of the Copenhagen Study in the rest of Denmark. ArchGenPsychiatry 51 (6), 442-455.
- Gottesman,Bertelsen, A., 2009. Confirming unexpressed genotypes for schizophrenia.Risks in the offspring of Fischer's Danish identical and fraternal discordant twins.Arch Gen Psychiatry 46 (10), 867-872.
- McRae, A.F., Powell, J.E., Henders, A.K., Bowdler, L., Hemani, G., Shah, S., Painter, J.N.,Martin, N.G., Visscher, P.M., Montgomery, G.W., 2014. Contribution of geneticvariation to transgenerational inheritance of DNA methylation. Genome Biology 15(5), 1-10.
- Castellani, C.A., Melka, M.G., Diehl, E.J., Laufer, B.I., O'Reilly, R.L., Singh, S.M., 2015.DNA methylation in psychosis: insights into etiology and treatment. Epigenomics 7(1), 67-74.
- Nestler, E.J., Pena, C.J., Kundakovic, M., Mitchell, A., Akbarian, S., 2015. Epigenetic BasisofMentalIllness. Neuroscientist.
- Teroganova, N., Girshkin, L., Suter, C.M., Green, M.J., 2016. DNA methylation in peripheraltissue of schizophrenia and bipolar disorder: a systematic review. BMC Genet 17 (1),27.
- Wong AH, Gottesman II, Petronis A. Phenotypic differences in genetically identical organisms: the epigenetic perspective,HumMol Genet, 2005, vol.14 Spec No 1.
- Costa, E., Chen, Y., Davis, J., Dong, E., Noh, J. S., Tremolizzo, L., et al. (2012). Reelin and schizophrenia: a disease at the interface of the genome and the epigenome. Molecular Interventions, 2(1), 47e57.
- Weinberger Daniel R. and Paul J Harrison. Schizophrenia, 3rd edition. Daniel R. and Paul J Harrison 2011 Blackwell Publishing Ltd. ISBN: 978-1-405-17697-2.
- Yang, J. Z., Si, T. M., Ruan, Y., et al. (2003) Association study of neurogulin 1 gene with schizophrenia. Mol. Psychiatry 8, 206–209.CrossRefGoogle Scholar.
- Crow TJ. The continuum of psychosis and its genetic origins. The sixty-fifth Maudsley lecture. Br. J. Psychiatry2005;156:788–797.
- Gokcumen O, Tischler V, Tica J, Zhu Q, Iskow RC, Lee E, Fritz MH, Langdon A, Stütz AM, Pavlidis P, Benes V, Mills RE, Park PJ, Lee C, KorbelJO.Primate genome architecture influences structural variation mechanisms and functional consequences.ProcNatlAcadSci U S A. 2013 Sep 24;110(39):15764-9. doi: 10.1073/pnas.1305904110.
- Huang H., Li J., Chen J.Y.Disease gene-fishing in molecular interaction networks: a case study in colorectal cancer.ConfProc IEEE Eng Med Biol Soc. 2009;2009:6416-9. doi: 10.1109/IEMBS.2009.5333750.
- Berretta S., Gisabella B., Benes F.M.: A rodent model of schizophrenia derived frompostmortem studies. Behav. Brain Res. 2009; 204: 363-368.
- Matrisciano F., Tueting P., Dalal I., Kadriu B., Grayson D.R., Davis J.M., Nicoletti F., GuidottiA.Epigenetic modifications of GABAergic interneurons are associated with the schizophrenia-like phenotype induced by prenatal stress in mice.Neuropharmacology. 2013 May;68:184-94. doi: 10.1016/j.neuropharm.
- Abi-Dargham A., Moore H. Prefrontal DA transmission at D1 receptors and the pathology of schizophrenia. SendtoNeuroscientist. 2003 Oct;9(5):404-16.
- RiceD. S., Curran T.Role of the reelin signaling pathway in central nervous system development .Annu. Rev. Neurosci. 2001. 24:1005–039.
- O'Dell R.S., Cameron D.A., Zipfel W.R., Olson E.C. Reelin Prevents Apical Neurite Retraction during Terminal Translocation and Dendrite Initiation.JNeurosci. 2015 Jul 29;35(30):10659-74. doi: 10.1523/JNEUROSCI.1629-15.2015.
- Abdolmaleky, H.M., Cheng, K.H., Russo, A., Smith, C.L., Faraone, S.V., Wilcox, M., Shafa, R., Glatt, S.J., Nguyen, G., Ponte, J.F., Thiagalingam, S., Tsuang, M.T., 2005. Hypermethylation of the reelin (RELN) promoter in the brain of schizophrenic patients: a preliminary report. Am J Med Genet B Neuropsychiatr Genet 134B (1), 60-66.
- Tochigi, M., Iwamoto, K., Bundo, M., Komori, A., Sasaki, T., Kato, N., Kato, T., 2008. Methylation status of the reelin promoter region in the brain of schizophrenic patients. BiolPsychiatry 63 (5), 530-533.
- Alelu-Paz, R., Gonzalez-Corpas, A., Ashour, N., Escanilla, A., Monje, A., GuerreroMarquez, C., Algora Weber, M., Ropero, S., 2015. DNA methylation pattern of genepromoters of major neurotransmitter systems in older patients with schizophrenia withFsevere and mild cognitive impairment. IntJ GeriatrPsychiatry 30 (6), 558-565.
- ImpagnatielloF.,PisuM.G., etal. A decrease of reline expression as a putative vulnerability factor in schizophrenia. ProcNatlAcadSciUSA. 2008; 95: 15718–15723.
- GuidottiA.,AutaJ., DavisJ.M., Di-Giorgi-GereviniV., DwivediY., GraysonD.R., etal. Decrease in reelin and glutamic acid decarboxylase 67 (GAD 67) expression in schizophrenia and bipolar disorder: a post- mortem brain study. Arch Gen Psychiatry. 2000; 57: 1061–1069.
- ImpagnatielloF.,CarunchoH., Niu S., Renfro A., Quattrocchi C.C., Sheldon M., D’ArcangeloG. ReelinpromoteshippocampaldendritedevelopmentthroughtheVLDLR/ApoER2-Dab1 pathway. Neuron.2004; 41: 71–84.
- GlantzL.A.,LewisD.A. Decreaseddendriticspinedensityonprefrontalcorticalpyramidalneuronsinschizophrenia. ArchGenPsychiatry. 2010; 57: 65–73.
- FatemiS.H.,KrollJ.L., StaryJ.M. Altered level of Reelin and it is o forms in schizophrenia and mood disorders. Neuroreport. 2011; 12: 3209–3215.
- Roth T.L., KleinmanJ.E.Epigeneticmechanisms in schizophrenia.BiochimBiophys Acta. 2014; 1790: 869–877.
- VeldicM.,GuidottiA., MalokuE., DavisJ.M., CostaE. Inpsychosis, corticalinterneuronsoverexpressDNA-methyltransferase 1. ProcNatlAcadSciUSA. 2015; 102: 2152–2157.
- Timothy D.,Folsomaand S.,HosseinFatemia. The Involvement of Reelin in Neurodevelopmental Disorders, Neuropharmacology. 2013 May ; 68: 122–135. doi:10.1016/j. neuropharm.
- Lim, D.H.K., Maher, E.R., 2010. DNA methylation: a form of epigenetic control of geneexpression. The Obstetrician &Gynaecologist 12 (1), 37-42.
- Wagner, J.R., Busche, S., Ge, B., Kwan, T., Pastinen, T., Blanchette, M., 2014. Therelationship between DNA methylation, genetic and expression inter-individualvariation in untransformed human fibroblasts. Genome Biology 15 (2), 1-17.
- Nishioka, M., Bundo, M., Kasai, K., Iwamoto, K., 2012. DNA methylation in schizophrenia: progress and challenges of epigenetic studies. Genome Med 4 (12), 96.
- DongE.,GuidottiA.ClozapineandsulpiridebutnothaloperidolorolanzapineactivatebrainDNAdemethylation. ProcNatlAcadSciUSA. 2008; 105: 13614–13619.
- Walton, E., Hass, J., Liu, J., Roffman, J.L., Bernardoni, F., Roessner, V., Kirsch, M.,Schackert, G., Calhoun, V., Ehrlich, S., 2016. Correspondence of DNA MethylationBetween Blood and Brain Tissue and Its Application to Schizophrenia Research.Schizophr Bull 42 (2), 406-414.
- Melas, P.A., Rogdaki, M., Osby, U., Schalling, M., Lavebratt, C., Ekstrom, T.J., 2012.Epigenetic aberrations in leukocytes of patients with schizophrenia: association ofglobal DNA methylation with antipsychotic drug treatment and disease onset. FASEBJ 26 (6), 2712-2718.
- Dempster, E., Viana, J., Pidsley, R., Mill, J., 2013. Epigenetic studies of schizophrenia:progress, predicaments, and promises for the future. Schizophr Bull 39 (1), 11-16.
- Provencal, N., Suderman, M.J., Guillemin, C., Massart, R., Ruggiero, A., Wang, D., Bennett,A.J., Pierre, P.J., Friedman, D.P., Cote, S.M., Hallett, M., Tremblay, R.E., Suomi,S.J., Szyf, M., 2012. The signature of maternal rearing in the methylome in rhesusmacaque prefrontal cortex and T cells. J Neurosci 32 (44), 15626-15642.
- Davies, M.N., Volta, M., Pidsley, R., Lunnon, K., Dixit, A., Lovestone, S., Coarfa, C., Harris,R.A., Milosavljevic, A., Troakes, C., Al-Sarraj, S., Dobson, R., Schalkwyk, L.C.,Mill, J., 2012. Functional annotation of the human brain methylome identifies tissuespecificepigenetic variation across brain and blood. Genome Biol 13 (6), R43.
- Klengel, T., Mehta, D., Anacker, C., Rex-Haffner, M., Pruessner, J.C., Pariante, C.M., Pace,T.W., Mercer, K.B., Mayberg, H.S., Bradley, B., Nemeroff, C.B., Holsboer, F., Heim,C.M., Ressler, K.J., Rein, T., Binder, E.B., 2013. Allele-specific FKBP5 DNAdemethylation mediates gene-childhood trauma interactions. Nat Neurosci 16 (1), 33-41.
- Marzi, S.J., Meaburn, E.L., Dempster, E.L., Lunnon, K., Paya-Cano, J.L., Smith, R.G., Volta,M., Troakes, C., Schalkwyk, L.C., Mill, J., 2016. Tissue-specific patterns ofallelically-skewed DNA methylation. Epigenetics 11 (1), 24-35.
- Monji, A., Kato, T.A., Mizoguchi, Y., Horikawa, H., Seki, Y., Kasai, M., Yamauchi, Y.,Yamada, S., Kanba, S., 2013. Neuroinflammation in schizophrenia especially focusedon the role of microglia. ProgNeuropsychopharmacolBiol Psychiatry 42, 115-121.
- Frick, L.R., Williams, K., Pittenger, C., 2013. Microglial dysregulation in psychiatric disease.ClinDevImmunol 2013, 608654.
- Ginhoux, F., Lim, S., Hoeffel, G., Low, D., Huber, T., 2013. Origin and differentiation ofmicroglia. Frontiers in Cellular Neuroscience 7 (45).
- Smalheiser, N.R., Costa, E., Guidotti, A., Impagnatiello, F., Auta, J., Lacor, P., Kriho, V.,Pappas, G.D., 2000. Expression of reelin in adult mammalian blood, liver, pituitaryparsintermedia, and adrenal chromaffin cells. ProcNatlAcadSci U S A 97 (3), 1281-1286.
- Kobold, D., Grundmann, A., Piscaglia, F., Eisenbach, C., Neubauer, K., Steffgen, J.,Ramadori, G., Knittel, T., 2002. Expression of reelin in hepatic stellate cells andduring hepatic tissue repair: a novel marker for the differentiation of HSC from otherlivermyofibroblasts. J Hepatol 36 (5), 607-613.
- Melas, P.A., Rogdaki, M., Osby, U., Schalling, M., Lavebratt, C., Ekstrom, T.J., 2012.Epigenetic aberrations in leukocytes of patients with schizophrenia: association ofglobal DNA methylation with antipsychotic drug treatment and disease onset. FASEBJ 26 (6), 2712-2718.
- Huang E. J., ReichardtL. F.Neurotrophins: Roles in Neuronal Development and Function. Annu Rev Neurosci. 2001; 24: 677–736. doi:10.1146/annurev.neuro.24.1.677.